Câncer de Próstata
Uro-Oncologista em SP
Introdução
O câncer de próstata é a neoplasia mais comum no homem, excetuando o câncer de pele, e a segunda causa mais comum de morte por câncer em homens. Nos países desenvolvidos, representa cerca de 15% dos casos de câncer em homens, enquanto no Brasil, esse índice chega a aproximadamente 30%. A incidência é menor na Ásia e maior nos países ocidentais como EUA e Suíça, possivelmente refletindo fatores como dieta, sedentarismo e diferenças étnicas.
A próstata se localiza logo abaixo da bexiga e tem como função principal a produção de fluidos seminais que nutrem os espermatozoides. O câncer nessa região pode se desenvolver de forma silenciosa, sem sintomas na fase inicial, o que torna essencial a realização de exames de rotina.
No Brasil, a Sociedade Brasileira de Urologia recomenda exames anuais para homens acima de 50 anos e, para aqueles com fatores de risco (história familiar, afrodescendência e obesidade), a partir dos 45 anos. O rastreamento inclui PSA (exame de sangue), toque retal e, em alguns casos, ressonância magnética da próstata.
Fatores de Risco
Diversos fatores contribuem para o risco de desenvolver câncer de próstata, sendo os principais:
- Idade: Abaixo de 45 anos é incomum desenvolver câncer de próstata, mas o risco aumenta progressivamente após os 50 anos.
- Histórico familiar: Se um parente de primeiro grau teve câncer de próstata, o risco de desenvolver a doença é duas vezes maior.
- Etnia: Estudos apontam maior incidência e agressividade da doença em afrodescendentes.
- Estilo de vida: Dieta rica em gorduras saturadas e pobre em fibras, obesidade e sedentarismo estão associados a um maior risco de desenvolvimento da doença.
- Fatores ambientais: Estudos sugerem que os japoneses têm baixa incidência da doença, mas ao migrarem para países ocidentais, a taxa se iguala à dos ocidentais, indicando forte influência do estilo de vida.
Sintomas
O câncer de próstata evolui de forma silenciosa e, na fase inicial, não costuma apresentar sintomas. Quando a doença progride, podem surgir sinais como:
- Alterações urinárias, incluindo aumento da frequência urinária, dificuldade para iniciar a micção, jato urinário fraco ou interrompido e necessidade de urinar várias vezes à noite.
- Dor ou ardência ao urinar.
- Dor óssea e cansaço, principalmente em casos avançados com metástases para ossos.
É importante ressaltar que muitas dessas queixas também podem estar relacionadas a condições benignas, como a hiperplasia prostática benigna (HPB), mas qualquer alteração urinária deve ser investigada por um urologista.
Diagnóstico
Exames iniciais
O diagnóstico do câncer de próstata começa com exames de rastreamento, que incluem:
- PSA (Antígeno Prostático Específico): Exame de sangue que pode indicar alterações na próstata. Níveis elevados podem sugerir câncer, mas também podem estar relacionados a inflamações ou aumento benigno da próstata.
- Toque retal: Exame clínico essencial para avaliar o tamanho, forma e consistência da próstata. Pode detectar endurecimento, assimetria ou presença de nódulos suspeitos, mesmo quando o PSA está dentro da normalidade.
- Ressonância magnética multiparamétrica: Atualmente é o exame mais sofisticado para avaliação detalhada da próstata. É um exame complementar essencial quando há suspeitas no PSA ou no toque retal.
Confirmação do diagnóstico
Se houver suspeita de câncer, o diagnóstico é confirmado por meio da biópsia transretal guiada por ultrassonografia com sedação, que consiste na retirada de pequenos fragmentos da próstata para análise. Hoje é possível realizar a biópsia utilizando a fusão da imagem da ressonância magnética com a ultrassonografia, o que aumenta a acurácia do exame. Além disso, também é possível realizar a biópsia transperineal, reduzindo o risco de infecção associado ao procedimento transretal tradicional.
Todo paciente que apresenta PSA elevado, alteração no toque retal ou na ressonância magnética precisa ser submetido à biópsia prostática.
O patologista classifica o câncer de próstata em um score chamado Gleason, que vai de 6 até 10, indicando a taxa de crescimento do tumor e a tendência de disseminação à distância (metástase). Esse score ajuda no planejamento cirúrgico e na indicação de outros tipos de tratamento, como radioterapia e/ou hormonioterapia.
Se o diagnóstico for confirmado, exames complementares podem ser necessários para avaliar a extensão da doença, como cintilografia óssea e PET-CT com PSMA, capazes de detectar lesões suspeitas para metástase.
Estratificação de Risco
Os pacientes com câncer de próstata são classificados em três grupos de risco:
- Baixo risco: PSA menor que 10 ng/mL, Gleason 6 e tumor restrito à próstata. Nesses casos, a taxa de cura ultrapassa 90%.
- Intermediário risco: PSA entre 10-20 ng/mL, Gleason 7 ou comprometimento maior da próstata.
- Alto risco: PSA acima de 20 ng/mL, Gleason 8 a 10 ou invasão para tecidos adjacentes. Aproximadamente 50% dos pacientes desse grupo apresentam recidiva em até 5 anos.
Essa classificação é essencial para definir a melhor estratégia terapêutica e necessidade de exames complementares antes do tratamento cirúrgico.
Tratamento
A escolha do tratamento depende da agressividade do tumor, do estado clínico do paciente e do estágio da doença. As principais opções incluem:
1. Cirurgia (Prostatectomia Radical Robótica)
A prostatectomia radical robótica, com ou sem linfadenectomia pélvica (retirada dos linfonodos pélvicos para verificar a presença de metástases), é considerada a técnica cirúrgica mais avançada. Ela oferece melhor controle oncológico e reduz os riscos de complicações como incontinência urinária e disfunção erétil. Conheça os detalhes da cirurgia.
2. Vigilância ativa
Pacientes com câncer de muito baixo risco podem ser acompanhados sem necessidade de tratamento imediato, realizando exames regulares e biópsias periódicas. Testes genéticos como o Oncotype® podem ajudar a prever a evolução do tumor.
3. Radioterapia e hormonioterapia
Pacientes que não podem ou não desejam passar por cirurgia podem optar por radioterapia, muitas vezes associada à hormonioterapia, que reduz os níveis de testosterona para conter o crescimento do tumor.
4. Tratamento do câncer de próstata metastático
Para os casos mais avançados, o tratamento envolve
hormonioterapia e, quando necessário,
quimioterapia sistêmica. O objetivo é reduzir a progressão da doença e controlar os sintomas.
Prevenção e Acompanhamento
A detecção precoce é a melhor forma de combater o câncer de próstata. A recomendação é que todos os homens a partir dos 40 anos procurem um urologista para uma avaliação personalizada.
Além disso, manter um estilo de vida saudável pode ajudar a reduzir o risco da doença. Praticar atividades físicas regularmente, evitar o excesso de gordura na alimentação, manter o peso controlado e não fumar são medidas fundamentais para a saúde da próstata.
contato
Agende uma Consulta
Dúvidas Frequentes
Para esclarecer as principais dúvidas sobre o câncer de próstata, acesse a seção com as 20 perguntas mais comuns feitas pelos meus pacientes durante a consulta.
O câncer de próstata é uma doença comum nos homens?
O câncer de próstata é o segundo tumor mais comum no homem, ficando atrás apenas do câncer de pele. Segundo o Instituto Nacional de Câncer (INCA), em 2020, foram diagnosticados 65.840 casos de câncer de próstata, correspondendo a 29,2% de todos os cânceres diagnosticados no Brasil. Infelizmente, 15.841 pessoas faleceram devido ao tumor de próstata, configurando a 2º maior causa de morte por câncer no Brasil.
As incidências eram mais elevadas no ocidente, mas atualmente observamos um aumento importante da incidência na Ásia, em países como o Japão. No Japão, em 2002, foram registrados 29.345 casos novos de câncer de próstata, mas em 2019, esse número subiu para 94.748, correspondendo ao tumor mais frequente no país na atualidade. Em parte, esse aumento pode ser justificado pela ocidentalização da cultura japonesa nas últimas décadas, assim como pelo aumento dos exames de rotina. Em 2020, no Japão, 12.759 pessoas faleceram por câncer de próstata.
Apesar dos dados expostos acima, nos últimos 20 anos, a mortalidade por câncer de próstata reduziu em 52%! A conscientização da população, a precisão no diagnóstico, a padronização da cirurgia e os avanços no tratamento sistêmico permitiram a queda importante na mortalidade dessa doença tão temida pelos homens. Para mais detalhes, veja o conteúdo neste link.
Quem deve fazer uma consulta de rotina com o médico urologista?
A consulta de rotina é essencial para qualquer homem que deseja desfrutar de boa saúde, boa funcionalidade ao longo da vida e detectar precocemente as doenças mais prevalentes em determinada faixa etária. Quando orientamos exclusivamente sobre o risco de câncer de próstata, levamos em consideração um dos protocolos mais renomados mundialmente que é do European Association of Urology (EAU), cuja diretriz foi atualizada no ano de 2022. O protocolo da Sociedade Brasileira de Urologia (SBU) possui diretrizes semelhantes ao EAU.
Recomendação de rastreamento de câncer de próstata EAU e SBU:
- Homens acima de 50 anos
- Homens acima de 45 anos, se afrodescendente ou história familiar de câncer
- Homem acima de 40 anos se portador de mutação genética BRCA2
O que é investigado na consulta de rotina com o uro-oncologista?
Na nossa consulta inicial, abrimos espaço para você relatar as suas queixas, angústias e dúvidas relacionadas à sua saúde. Em seguida, farei perguntas específicas para avaliar se você apresenta algum sintoma relacionado a problemas da próstata.
As duas doenças que mais comumente acometem a próstata são: a hiperplasia (aumento do tamanho) da próstata e o câncer de próstata.
Os sintomas urinários são divididos em 3 categorias:
- Sintomas de armazenamento: aumento da frequência urinária, noctúria, urgência, incontinência urinária
- Sintomas de esvaziamento: jato fraco, intermitência, hesitação, esforço miccional
- Sintomas pós miccionais: sensação de esvaziamento incompleto e gotejamento pós miccional
Durante o exame físico, investigamos se você possui hérnia inguinal, dor na região da bexiga e, se o paciente consentir, realizamos o toque retal. O exame do toque permite estimar o tamanho da próstata, identificando facilmente próstatas volumosas (hiperplasia prostática) e, também, se há nódulo endurecido e suspeito para o câncer de próstata. O exame do toque não permite examinar todas as regiões da próstata, por isso, completamos, sempre que possível, com exames de imagem. Exames genitais são realizados de acordo com queixa específica apresentada pelo paciente.
Uma mensagem para todos os homens que não desejam realizar o toque retal: nossa missão não é te convencer a realizar o toque retal, mas dentro de todos os recursos que nós temos, te oferecer a oportunidade de diagnosticar uma doença em fase precoce. Se não deseja realizar o toque retal, não tem problema! Marque uma consulta para conversar, tirar as suas dúvidas, realizar o exame de sangue (PSA) e exame de imagem (ressonância magnética, se possível) para avaliação adequada da sua próstata. Não deixe de se cuidar!
Quais exames podem ser solicitados na consulta?
Ao passar por consulta, dependendo das hipóteses diagnósticas e dos achados no exame físico, podemos solicitar exames de sangue, urina e imagem para avaliação completa da sua saúde urológica. Os dois parâmetros mais importantes para decidir a necessidade de realizar uma biópsia de próstata são a densidade de PSA (PSA total / volume da próstata) e a classificação da suspeita de câncer de próstata pela RNM multiparamétrica de próstata (PI-RADS score).
Leia abaixo sobre o que cada um dos exames permite avaliar.
Exames de sangue
- Creatinina: avaliação da função do rim;
- Testosterona e outros hormônios: avaliação de disfunção sexual;
- PSA: estimar o risco de câncer de próstata, juntamente com a história clínica, toque retal e/ou exame de imagem. É importante lembrar que não existe um valor de PSA que é considerado totalmente seguro, pois existe câncer de próstata com PSA normal e, também existe aumento do PSA que não é causado por câncer de próstata;
- PSA livre/total: embora pouco utilizado na prática clínica atual, a relação do PSA livre baixo em relação ao PSA total chama atenção para o risco de câncer de próstata;
- Velocidade de aumento do PSA: analisamos o aumento do PSA de ano em ano; o aumento progressivo apesar do volume da próstata relativamente constante chama atenção para o risco de câncer de próstata;
- Densidade de PSA: atualmente é considerado um dos parâmetros mais importantes a ser analisado durante a sua consulta de rotina. Trata-se da relação entre o valor absoluto do PSA total em relação ao peso estimado da próstata. Densidade acima de 0,20 têm risco maior de câncer de próstata e deve ser complementado com RNM para avaliar a indicação de biópsia de próstata.
Exame de urina
- Urina 1: analisa indícios de infecção urinária e sangramento na urina;
- Urocultura: pode identificar a bactéria responsável pela infecção urinária; exame importante a ser realizado antes de qualquer procedimento urológico invasivo para evitar agravamento de uma infecção pré-existente;
Exame de imagem
- Ultrassonografia de vias urinárias e próstata: avalia a morfologia do rim e o tamanho da próstata. Esse exame não permite diferenciar com segurança um nódulo suspeito de câncer de próstata de um nódulo benigno;
- Ressonância multiparamétrica de próstata (RNMmp): é o exame que melhor caracteriza os nódulos dentro da próstata e a chance de um determinado nódulo ser câncer. Permite estimar o tamanho da próstata, além de permitir a análise de regiões da próstata que não conseguimos atingir durante o exame de toque retal. O médico radiologista estima o risco de câncer de próstata de acordo com vários parâmetros das imagens obtidas na RNMmp e classifica em um score conhecido como PI-RADS, Prostate Imaging Reporting & Data System. Esse score vai de 1 a 5, sendo que os scores 4 e 5 significam que o risco de estar com câncer de próstata clinicamente relevante é superior a 30-40%. Scores 4 e 5 devem ser submetidos a biópsia de próstata, assim como score 3 associado a densidade de PSA acima de 0,15;
- Estudo urodinâmico: estudo que permite aferir a pressão dentro da bexiga e ajuda na identificação da causa da dificuldade miccional. Não são todos os pacientes que precisam realizar esse exame.
Fiz os exames solicitados: o que será avaliado no retorno?
Ao retornar na consulta com os exames, nós vamos estimar o risco de câncer de próstata e analisar se você tem aumento do tamanho da próstata. Você pode se enquadrar em uma das seguintes possibilidades:
1. Não tem suspeita de câncer de próstata e não apresenta dificuldade para urinar.
Nesse caso, você vai continuar realizando a sua consulta de rotina anualmente ou no período solicitado pelo seu urologista.
2. Não tem suspeita de câncer de próstata, porém tem dificuldade miccional ou aumento da próstata nos exames.
Nesse caso, será necessário tratar a hiperplasia de próstata e os seus sintomas. Veja no meu site os tratamentos disponíveis.
3. Suspeita de câncer de próstata: PSA elevado, alteração no toque retal ou exame de imagem alterado (RNMmp de próstata por exemplo).
Caso apresente alteração do PSA ou toque retal, é essencial a realização da ressonância magnética antes de realizar a biópsia de próstata. Existem calculadoras que estimam o risco individual de estar com câncer de próstata baseado nos seguintes parâmetros: história familiar, PSA, exame físico e exames de imagem.
Quem precisa realizar a biópsia de próstata?
Atualmente, os 2 parâmetros mais importantes para analisar a indicação de biópsia de próstata são a densidade de PSA (PSA total/peso da próstata) e RNMmp de próstata.
- PI-RADS 1 ou 2: densidade > 0,20 a biópsia pode ser considerada;
- PI-RADS 3: densidade > 0,20 deve realizar biópsia; > 0,15 deve considerar fortemente a biópsia;
- PI-RADS 4 ou 5: todos devem realizar biópsia.
A imagem da RNMmp antes da biópsia é importante para permitir a identificação precisa da área suspeita, reduzindo a chance de mostrar uma área não representativa no momento da biópsia, assim permitindo um procedimento com mais acurácia para identificar o câncer de próstata.
Como é feita a biópsia da próstata?
Atualmente existem dois tipos de biópsias guiados por exame de ultrassonografia. O método tradicional é realizado com ultrassonografia transretal (a agulha da biópsia passa pelo reto e consegue captar o fragmento da próstata). No método mais recente, a biópsia é realizada pela região perineal (região entre o escroto e o ânus).
Antigamente as biópsias eram realizadas de forma randômica obtendo 12 fragmentos de regiões pré estabelecidas (6 fragmentos de cada lado da próstata; 2 fragmentos na região do ápice mais próximo da uretra, 2 na região média e 2 na região da base mais próxima da bexiga). Atualmente, há recomendação de realizar a RNMmp antes da biópsia, pois permite identificar possíveis lesões que não são contempladas nessas regiões randômicas (por exemplo, lesão mais anterior na próstata) e permite obter fragmentos adicionais de áreas suspeitas na RNMmp, reduzindo assim a situação na qual há risco elevado de câncer de próstata, mas a biópsia não confirma essa suspeita. Hoje, é indicado a biópsia de 12 fragmentos randômicos, além de 3 a 5 fragmentos adicionais para cada nódulo suspeito na RNMmp.
As biópsias podem ser realizadas com aparelhos modernos que permitem a fusão da imagem da ressonância com a da ultrassonografia, permitindo identificar com o ultrassom a região suspeita na ressonância com precisão. Essa fusão pode ser feita também de forma cognitiva, ou seja, o especialista que realiza a biópsia visualiza a ressonância e identifica com a ultrassonografia a região suspeita para realizar a biópsia. Esse método de fusão permite identificar a lesão alvo e realizar a biópsia com maior acurácia.
As duas complicações principais relacionadas à biópsia são a infecção urinária e o sangramento na urina ou no esperma (hematúria e hematospermia). A biópsia transperineal reduziu de forma importante a incidência da infecção associada à biópsia. Por isso, tem se tornado método de escolha em países desenvolvidos, apesar de ter um custo mais elevado. Ao realizar a biópsia transretal é importante utilizar adequadamente o antibiótico para reduzir o risco de infecção. No caso da biópsia transperineal, pode ter um pouco mais de dor associado ao procedimento, necessitando de anestesia local adequada para minimizar qualquer desconforto durante o exame. Você pode discutir com o seu médico, os prós e contras de cada modalidade, mas o mais importante é tomar todas as medidas possíveis para você reduzir o desconforto e complicações associadas ao exame.
O sangramento na urina após a realização de biópsia da próstata geralmente dura poucos dias e pode ser resolvida com uma boa hidratação oral no pós-procedimento, na maioria dos casos. Caso o sangramento seja persistente pode haver a necessidade de passar uma sonda e lavar a bexiga. No caso de biópsia transretal, pode apresentar sangramento nas fezes, geralmente transitório.
Pessoalmente, eu recomendo aos pacientes a realização da biópsia de próstata sob sedação endovenosa para reduzir ao máximo qualquer desconforto associado ao procedimento.
Como entender o resultado da biópsia de próstata?
O médico patologista analisa as anormalidades da arquitetura dos fragmentos de tecido prostático obtidos na biópsia. O patologista classifica essas anormalidades em um score chamado Gleason, que varia de 1 a 5. Cada fragmento da biópsia é avaliado no microscópio e, para cada um deles, os scores das duas regiões com maiores alterações são somados para descrever o score final do Gleason daquele fragmento. Assim, para cada fragmento da biópsia que contém câncer, o score de Gleason final será descrito com uma “nota” que variará de 6 a 10. Cabe ressaltar que embora a somatória do score de Gleason possa variar de 2 a 10, atualmente, o score final inferior a 6, não é considerado câncer de próstata.
A classificação adequada do Gleason é importante para o cirurgião interpretar a gravidade da doença. Quanto mais a célula tumoral for diferente da célula normal, dizemos que é um tumor indiferenciado e isso recebe score de Gleason maior, caracterizando um tumor mais agressivo. Os tumores mais agressivos (Gleason 8 a 10) tendem a invadir os tecidos adjacentes à próstata, além de maior risco de metástase para linfonodos ou ossos. Outro aspecto muito importante é a extensão do tumor que podemos analisar com o resultado da biópsia. Assim, a presença de um tumor Gleason 6 em 1 fragmento dentre 15 fragmentos mostra um tumor provavelmente de baixa agressividade. Por outro lado, Gleason 8 em 10 de 12 fragmentos mostra um tumor agressivo e extenso, já que mais de 80% do tecido analisado continha células com câncer. Quanto maior a proporção de fragmentos com câncer, maior será o risco desse tumor apresentar metástase ou necessitar de diversas modalidades terapêuticas para o controle da sua doença.
Atualmente o score Gleason vem sendo substituído por uma classificação elaborada pela Sociedade Internacional de Patologia Urológica (ISUP grade – Internatinal Society of Urological Pathology) que varia de grau 1 a 5. O ISUP possui correspondência aproximada com o Gleason score e nos auxilia a classificar os tumores de próstata em grupos de risco (essa classificação se baseia no Gleason/ISUP, PSA e estadiamento do paciente; explicarei mais adiante).
- Baixo risco: ISUP 1 → Gleason 6;
- Risco intermediário favorável: ISUP 2 → Gleason 7 (3+4);
- Risco intermediário desfavorável: ISUP 3 → Gleason 7 (4+3);
- Alto risco: ISUP 4 (Gleason 8) e ISUP 5 (Gleason 9 ou 10);
Quanto ao tipo histológico de câncer de próstata, o adenocarcinoma acinar é o mais comum.
O que é o estadiamento do câncer de próstata?
Após o diagnóstico de câncer de próstata, o próximo passo a ser tomado é o estadiamento. Entende-se por estadiamento a realização de exames de imagem para determinar a extensão da doença e a presença de metástase (quando as células tumorais vão para outro local do corpo).
Os exames mais comumente empregados são RNMmp de próstata, tomografia (TC) de tórax, abdome e pelve, cintilografia óssea (CO) e PET-CT com PSMA.
- A RNMmp é o melhor exame para avaliar a extensão local do tumor de próstata. Ele permite identificar a localização, o tamanho e a proximidade do nódulo do câncer com o feixe neurovascular relacionados à ereção, além de permitir avaliar os ossos da bacia e os linfonodos pélvicos. Por isso, é um exame muito importante tanto no estadiamento, quanto na programação da cirurgia para planejar de forma segura a preservação do feixe nervoso relacionado à potência sexual. Se esse exame já foi realizado antes da biópsia, não há necessidade de repetir.
- A TC de tórax, abdome e pelve não permitem analisar com detalhes a posição do nódulo e a relação da próstata com as estruturas adjacentes. Mas é um exame importante para verificar se existem metástases no pulmão e fígado e, também, para analisar os linfonodos localizados fora da região pélvica, os quais não podem ser avaliados pela RNM de próstata. Cabe ressaltar que tanto a TC quanto a RNMmp só permitem suspeitar que linfonodos aumentados de tamanho ou com alterações da morfologia estejam acometidos pelo câncer. Esse exame não consegue detectar micrometástase, que são diminutas metástases presentes nos linfonodos, mas que não alteram seu tamanho e morfologia. O melhor exame para avaliar a presença de micrometástase é o PET-CT com PSMA.
- A CO é um exame que analisa a presença de metástase nos ossos. Ele também detecta alterações benignas relacionadas ao envelhecimento ou trauma prévio. Por isso, quando positivo, o resultado do exame deve ser analisado com cuidado ou complementado com TC ou RNM, a depender do caso.
- A PET-CT com PSMA é o exame mais acurado para o estadiamento do câncer de próstata. Ele identifica metástases de pequeno tamanho localizadas em diferentes órgãos como pulmão, osso ou em linfonodos de tamanho normal, porém suspeitos para acometimento pelo câncer (RNM e TC só permitem identificar linfonodos suspeitos quando eles estão aumentados de tamanho, mas existem metástases em linfonodo de tamanho normal também). Esse exame é muito importante para o estadiamento de tumores mais agressivos (alto risco) ou caso apresente recidiva ou progressão da doença, a fim de se detectar precocemente pequenas metástases e programar o seu tratamento subsequente.
Os exames necessários variam conforme a agressividade da doença e a probabilidade de metástase. Assim, se o tumor é pequeno e de baixo risco não precisa ser investigado com exames como PET-CT com PSMA, porém em pacientes com tumor de alto risco, é muito importante fazer exames mais acurados para determinar a presença de metástase.
Apesar dos exames mais modernos, o melhor método para detectar se algum linfonodo da região pélvica está comprometido pelo câncer de próstata é retirá-lo durante a cirurgia da próstata, isto é, realizar a linfadenectomia pélvica, e analisá-lo no microscópico à procura de células tumorais. A necessidade de retirar os linfonodos se baseia no risco de ter metástase linfonodal, por isso, se o risco for baixo (< 5%) não é necessário realizar a linfadenectomia. Caso a cirurgia para retirada dos linfonodos (linfadenectomia) seja necessária, deve-se realizá-la com a extensão correta, pois linfadenectomia limitada a uma pequena área não consegue realizar o estadiamento adequado.
Como eu sei se o câncer está somente na próstata?
Por meio do estadiamento adequado e individualizado para cada paciente, podemos, de forma didática, classificar o câncer de próstata em 3 tipos. Essa classificação é fundamental, pois determina o tratamento adequado, a chance de cura e a necessidade de tratamento complementar. Veremos mais adiante, mas o tumor localizado e localmente avançado é tratado inicialmente com cirurgia e/ou radioterapia, e o tumor metastático, com uso de bloqueio hormonal que pode ser associado a antiandrogênicos modernos ou quimioterapia. A tendência do câncer de próstata é ter um crescimento progressivo e migrar do estágio localizado para localmente avançado e, posteriormente, para metastático. O objetivo das consultas de rotina é identificar precocemente a doença em sua fase inicial ou localizada.
Entenda as fases do câncer de próstata:
- Localizado: tumor restrito somente à próstata;
- Localmente avançado: tumor ultrapassando o limite da próstata ou invadindo a vesícula seminal que fica atrás da próstata ou, ainda, quando tem suspeita de metástase nos linfonodos pélvicos próximos da próstata;
- Metastático: tumor que se espalhou para linfonodos distantes, ossos ou órgãos como fígado e pulmão.
Como é feita a classificação do câncer de próstata em grupos de risco?
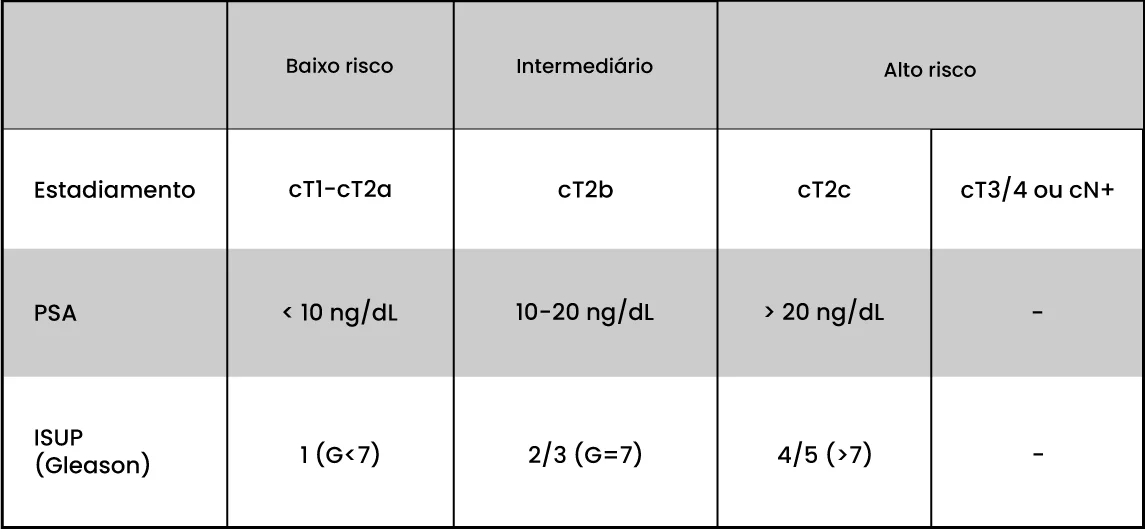
O câncer de próstata pode ser classificado de acordo com o guideline da EAU (European Association of Urology) ou NCCN (National Comprehensive Cancer Network). EAU classifica em baixo, intermediário e alto risco. NCCN classifica em muito baixo risco, baixo risco, intermediário (favorável e desfavorável), alto e muito alto risco. Em ambas as classificações, o PSA, o score Gleason e o exame físico/estadiamento local são utilizados para determinar a gravidade e o risco do câncer. Veja abaixo a tabela com a classificação EAU.
Classificação EAU
Quando classificamos em grupos de risco, estamos nos referindo ao risco de necessitar de tratamentos adicionais após a cirurgia ou radioterapia, de ter metástase ao longo da vida ou do tumor recidivar após o tratamento inicial. O tumor de baixo risco tem elevado índice de cura com o primeiro tratamento empregado (cirurgia ou radioterapia), mas os tumores de alto risco e muito alto risco exigem geralmente tratamentos multimodais (vários tipos de tratamentos sequenciais) para o controle adequado do câncer para que possa prolongar a sobrevida do paciente mantendo sua qualidade de vida.
Quais são os tratamentos curativos disponíveis atualmente?
O tratamento depende da classificação de risco do câncer de próstata:
Vigilância ativa para câncer de baixo risco possivelmente indolente
Tumor de muito baixo risco ou baixo risco com critérios pré-determinados podem ser acompanhados com exames regulares e biópsia seriada, sem a necessidade de tratamento curativo tradicional com cirurgia ou RDT. 50% desses pacientes bem selecionados permanecem com os tumores pequenos após o seguimento de 5 a 10 anos, às vezes até indetectável em alguns exames, sem a necessidade de se submeter a qualquer procedimento com risco de gerar efeitos colaterais, como impotência sexual por exemplo. Embora 50% permaneçam com os tumores pequenos, os outros 50% apresentam progressão ao longo do seguimento de 5 a 10 anos. Portanto, é importante realizar os exames regularmente para detectar se houve mudança no comportamento do tumor ou se há risco de progressão e, portanto, necessidade de tratamento curativo tradicional como cirurgia ou RDT.
Câncer localizado ou localmente avançado
Para tumores com localização restrita à próstata ou à região da pelve, os dois tratamentos curativos mais adequados são a prostatectomia radical e a radioterapia externa (RDT). Atualmente, a prostatectomia robótica é a primeira escolha, sempre que possível. Outros métodos cirúrgicos incluem a prostatectomia laparoscópica ou convencional (aberta). A cirurgia robótica permite a realização de um procedimento seguro e preciso com resultados oncológicos excelentes, além de resultar em uma recuperação mais rápida e com menor risco de incontinência urinária e impotência sexual.
A RDT vem apresentando melhoria técnica importante, atualmente com cada vez menos efeitos colaterais. O padrão atual é usar o método que possa modular a intensidade e ser guiado por exame de imagem para evitar efeitos colaterais em órgãos adjacentes à próstata, como a bexiga e o reto. Outra opção de RDT que existe é a braquiterapia (colocação de implantes radioativos dentro da próstata, permitindo uma dose de radiação maior em período mais curto).
Dependendo do grupo de risco, há indicação de associar o bloqueio hormonal por um determinado período para aumentar a chance de cura. No risco intermediário geralmente é associado 6 meses e, no alto risco, de 2 a 3 anos. Para os pacientes que fizeram RDT no passado e que o tumor recorreu, re-irradiação (nova RDT externa) com técnica estereotáxica tem sido utilizado como tratamento de resgate com menor toxicidade em relação à prostatectomia de resgate em alguns estudos. Mas, ainda se trata de método recente e cada paciente deve ser avaliado individualmente para concluirmos se ele é candidato para receber esse tratamento.
Tratamentos focais como HIFU (High Intensity Focused Ultrasound ou Ultrassom focalizado de alta intensidade) e crioterapia ainda estão em fase de estudos para avaliar a segurança e eficácia a longo prazo. Embora não seja uma prática rotineira no momento, existe espaço para a utilização da terapia focal no tratamento de tumores pouco agressivos ou para os casos de recidiva tumoral localizada somente na próstata, após o primeiro tratamento com radioterapia, por exemplo. Ainda necessitamos de dados a longo prazo para utilizar essa modalidade de tratamento com segurança na prática clínica
Quais cuidados durante a cirurgia permitem melhores resultados?
O tratamento cirúrgico do câncer de próstata passou por uma evolução muito importante nas últimas duas décadas. O conhecimento mais detalhado da anatomia da próstata, assim como das estruturas envolvidas na continência urinária (capacidade de segurar a urina) e na potência sexual, isto é, dos feixes neurovasculares que passam posterior e lateralmente às proximidades da próstata, proporcionou uma redução gradativa dos efeitos colaterais do tratamento cirúrgico, como sangramento, incontinência urinária e impotência sexual. Atualmente a cirurgia robótica tem sido o método padrão em diversos países, inclusive no Brasil em hospitais que têm disponibilidade. Veja os detalhes e vantagens da cirurgia nesse link.
É uma preocupação constante do cirurgião oferecer a maior chance de cura, mas, ao mesmo tempo, menor morbidade associada ao procedimento, permitindo ao paciente o retorno às atividades habituais o mais precocemente possível, além de manter a qualidade de vida após o tratamento.
Nesse sentido, a cirurgia robótica agrega muitos benefícios no tratamento do câncer de próstata. A prostatectomia radical robótica reduz de forma importante o risco de sangramento, além de auxiliar na melhor recuperação funcional, isto é, na continência e potência sexual após a cirurgia. A mobilidade das pinças cirúrgicas e a imagem de alta qualidade em 3D permitem um procedimento seguro e preciso, auxiliando o cirurgião no momento da preservação das estruturas envolvidas na continência e potência sexual. Mesmo em tumores localmente avançados, tem sido demonstrada a segurança da realização da cirurgia robótica no que diz respeito às chances de cura após o tratamento cirúrgico.
Como é a cirurgia da próstata e a recuperação no pós-operatório?
A investigação detalhada e o planejamento correto são fundamentais para obter um excelente resultado no tratamento do câncer de próstata. Durante a nossa consulta, classificaremos o tumor conforme o grupo de risco e faremos o estadiamento apropriado. A imagem da RNMmp da próstata será essencial para o planejamento da sua cirurgia. Antes da cirurgia, você será submetido à avaliação do risco cirúrgico.
A internação ocorre na véspera da cirurgia. Geralmente utilizamos a anestesia geral associada à peridural para reduzir ao máximo o desconforto no pós-operatório.
A cirurgia tem duração estimada de 2 a 3 horas, dependendo da necessidade de retirar os linfonodos (linfadenectomia), do tamanho da próstata e da presença de infecção prostática prévia. A cirurgia é realizada através de 6 incisões no abdome inferior que medem de 0,5 a 1 cm. A incisão localizada próximo do umbigo pode ser ampliada o suficiente para permitir a retirada da próstata com segurança ao final do procedimento. Os fios utilizados para o fechamento dessas pequenas incisões são absorvíveis, ou seja, não há necessidade de retirar os pontos no retorno após a alta.
Após o procedimento, o paciente é encaminhado para o quarto onde recebe a alimentação e, no mesmo dia da cirurgia, é permitido caminhar com auxílio. No dia seguinte à cirurgia, o paciente realiza fisioterapia. A alta geralmente ocorre 24 – 48 horas após a cirurgia.
O paciente permanece com sonda vesical, em média, por 7 dias. Essa sonda é retirada no consultório e reavaliamos a continência urinária em poucas semanas. Caso ainda tenha alguma dificuldade para segurar a urina, iniciamos a fisioterapia do assoalho pélvico. Os pontos são absorvidos em 3-4 semanas em média, por isso, não precisamos manipular a região da incisão para retirar os pontos no consultório. Quando o paciente estiver plenamente recuperado, planejamos e iniciamos as terapias que podem ajudar na recuperação da potência sexual.
Mesmo tirando a próstata o tumor pode voltar?
Infelizmente, mesmo retirando a próstata com a cirurgia, o tumor pode voltar (recidivar). Existem duas possibilidades de recidiva do tumor: recidiva local e recidiva à distância.
A primeira possibilidade é quando o nódulo do câncer tem um grande volume e é agressivo, por isso pode ficar células microscópicas do tumor na proximidade do local da retirada da próstata. Esse tipo de recidiva é conhecida como recidiva local. Essas células pequenas não são visíveis inicialmente, mas podem se multiplicar, crescer e produzir PSA, o qual poderá ser detectado no exame de sangue, permitindo o diagnóstico da recidiva. Quando o exame de sangue mostra a recidiva do tumor, utilizamos métodos de imagens modernos como RNMmp ou PET-CT com PSMA para prosseguir a investigação do local exato da recorrência tumoral. Às vezes, detectamos no exame de PSA que o tumor voltou, mas as imagens não mostram o local exato da recidiva tumoral. Essa situação é denominada recidiva bioquímica não metastática, pois diagnosticamos a recidiva por meio do exame de sangue, mas ainda não conseguimos enxergar o local da metástase.
Quando o paciente apresenta somente uma recidiva local, pode ser feita radioterapia complementar na região operada para tentar destruir essas células que estão em crescimento. Por isso, a radioterapia nesse cenário pode ser curativa, ou seja, ela pode destruir todas as células que estão na região previamente operada.
A segunda possibilidade é que antes do tratamento cirúrgico para a retirada da próstata, alguma célula microscópica do câncer migrou para algum linfonodo ou outros órgãos como osso, fígado e pulmão. Os exames de estadiamento para avaliar se existem metástases tumorais só conseguem detectar um nódulo formado por um conglomerado de células tumorais. Por isso, quando existem poucas células que migraram para outro local do corpo, isso não é visível nos exames. Essa situação na qual existem células que migraram para outra região do corpo e que são invisíveis aos exames de imagem, é conhecida como micrometástase. Nos casos de micrometástases, o nível de PSA cai para valores considerados normais, após a cirurgia. Mas, ao longo do acompanhamento pós-operatório o nível de PSA começa a subir e, posteriormente, descobrimos um linfonodo aumentado ou um nódulo em algum outro local do corpo, caracterizando a metástase. Portanto, a micrometástase é uma metástase que ainda não conseguimos detectar com os exames disponíveis. Como geralmente as células pequenas migram para várias regiões do nosso organismo, a radioterapia não é eficaz e utilizamos o bloqueio hormonal como tratamento inicial para suprimir o crescimento dessa recidiva à distância. A chance de cura nessa situação é pequena, mas existe tratamento para controlar a progressão do tumor.
Como é feito o seguimento após o tratamento do câncer de próstata?
O seguimento é feito com a dosagem seriada do PSA no exame de sangue. Após a cirurgia, o valor do PSA cai rapidamente. Realizamos a primeira dosagem em 4-6 semanas após a prostatectomia. O esperado é que o valor do PSA esteja abaixo de 0,2 ng/dL (a tendência atual é utilizar o valor 0,1ng/dL como referência).
Se o PSA permanecer elevado após a cirurgia (situação conhecida como persistência bioquímica), isso pode significar que existe doença residual próximo à próstata ou doença em outro local do corpo, ou seja, metástase. Para entender a situação de cada paciente, analisamos o valor do PSA após a cirurgia, os exames pré-operatórios (PSA antes da cirurgia, resultado da biópsia e exames de imagem), além do relatório anatomopatológico, que é uma análise da próstata e dos linfonodos retirados na cirurgia pelo médico patologista o qual emitirá um laudo final detalhando vários parâmetros relacionados ao tumor. Por outro lado, se o PSA permanecer abaixo de 0,2 e apresentar aumento consecutivo, ultrapassando esse valor, será considerado recidiva tumoral e necessitará de novos exames de estadiamento e/ou tratamento complementar.
Após a radioterapia (RDT), o valor do PSA cai gradativamente. O nadir (valor mais baixo) após o término da RDT ocorre em torno de 18-24 meses após o término. Por isso, fazemos dosagens seriadas para acompanhar a queda do PSA após o fim da RDT. No caso da RDT, existe um critério conhecido como Phoenix que define a recidiva tumoral após a RDT como sendo o valor do nadir mais 2 unidades. Por exemplo, se o nadir foi 0,6ng/dL, ao ultrapassar 2,6ng/dL definimos como recidiva do tumor. Provavelmente esse critério será atualizado, pois aguardar o aumento de 2 unidades para definir como recidiva pode retardar a indicação dos tratamentos de resgate.
Dependendo do grupo de risco, a associação de bloqueio hormonal com a RDT melhora o resultado do tratamento. O período de tratamento medicamentoso pode variar de 6 meses, se paciente com risco intermediário; até 2 a 3 anos, se o paciente for de alto ou muito alto risco. Quando utilizado bloqueio hormonal associado com a RDT, precisamos aguardar a recuperação do nível hormonal (testosterona) para entender, de fato, o controle da doença que a RDT propiciou. Caso o PSA comece a subir após a suspensão do medicamento, isso significa que a RDT não conseguiu eliminar todas as células tumorais e o paciente necessitará de tratamento complementar.
Como eu posso saber o risco de o tumor voltar?
A classificação do grupo de risco reflete o risco de recidiva tumoral. Assim, o câncer de alto risco têm maior possibilidade de recidiva, e o de baixo risco, menor. Existem nomogramas (calculadoras) em que utilizamos os parâmetros da biópsia, PSA, informações da RNMmp e informações da peça cirúrgica analisada detalhadamente no laboratório (anatomopatológico) para estimar o risco individual do câncer voltar após o tratamento inicial. Por isso que é tão importante realizar a análise da peça cirúrgica em laboratório de confiança, pois vários parâmetros importantes são definidos nessa análise como o score Gleason final, o tamanho do nódulo, a proporção da próstata acometida pelo tumor, o estadiamento final (se o tumor estava ultrapassando o limite da próstata) e se há linfonodos comprometidos.
Existem critérios de exame de sangue que permitem identificar a recidiva do tumor após a cirurgia ou após a radioterapia. O mais importante é reconhecer os pacientes que apresentam alta chance de recidiva, a fim de detectá-la precocemente e indicar o tratamento complementar de resgate. Dessa forma, mesmo nesse momento de recorrência do tumor, existem opções de tratamento que podem ser curativas
Se o tumor voltar, existe tratamento?
Quando detectamos no exame de sangue a provável recorrência do tumor, chamamos isso de recidiva bioquímica. Após constatar a recidiva bioquímica, realizamos novamente o estadiamento para tentar identificar o local suspeito de recidiva tumoral, que pode ser: 1) a loja prostática, que é o local onde a próstata estava, uma região próxima à bexiga; 2) linfonodos da região pélvica ou 3) metástase à distância. Isso é muito importante, pois a recorrência na loja da próstata ou nos linfonodos da pelve podem ser tratadas com radioterapia ou prostatectomia de resgate, a depender do tratamento inicial que foi realizado antes da recidiva, mas as metástases são tratadas com medicamentos, podendo ou não ser combinado com outras modalidades.
Os exames que podem ser utilizados nesse momento de recidiva são a RNMmp com cintilografia óssea ou idealmente o PET-CT com PSMA, que permite identificar lesões pequenas que outros exames não conseguem. Mesmo assim, pode haver a situação em que existe recidiva bioquímica e os exames de estadiamento não mostram nenhum tumor visível. Nesse caso, consideramos como ausência de metástase e procedemos com tratamento de resgate. Inclusive alguns estudos mostraram que nos casos em que os exames de imagem não mostram nenhuma alteração detectável, o tratamento de resgate tem resultado mais favorável.
Se o tumor recidivar após a cirurgia, pode ser realizado RDT de resgate com intenção de cura, caso os exames de estadiamento não mostrem tumor à distância (metástase). Frequentemente associamos o bloqueio hormonal por 6 meses à RDT de resgate.
Se a recidiva for após a RDT, a opção curativa é a prostatectomia de resgate. Em relação àqueles pacientes que fizeram a cirurgia de imediato, a prostatectomia de resgate apresenta maior risco de incontinência urinária e impotência sexual. Devido a essa morbidade, há várias pesquisas com tratamentos focais promissores, mas que ainda não foram totalmente incorporados na prática clínica, que incluem HIFU (High Intensity Focused Ultrasound) ou ultrassom focalizado de alta intensidade, crioterapia e re-irradiação (nova RDT externa).
Como é feito o tratamento de câncer metastático?
O tratamento direcionado para os tumores mais avançados vem apresentando atualizações constantes nas últimas duas décadas. Caso no momento dos exames iniciais seja descoberto alguma lesão distante da próstata, isso caracteriza o tumor que sofreu metástase. Outra situação em que detectamos a presença de metástase é quando após o tratamento com cirurgia ou radioterapia, o paciente evolui com aumento progressivo do PSA e, nos exames de imagem, é diagnosticada uma lesão metastática. Quando isso ocorre, geralmente, é porque alguma célula do tumor inicial tinha migrado para outra região do corpo, mas estava invisível (conhecido como micrometástase) e se tornou visível com o seu crescimento (aumenta o PSA e pode ser detectado em exames de imagem).
O tratamento principal para o câncer de próstata metastático é o bloqueio hormonal ou hormonioterapia que tem como objetivo reduzir a produção do hormônio masculino testosterona. Com isso, um dos substratos utilizados no crescimento tumoral deixa de ser oferecido ao tumor, permitindo desta forma a inibição das células tumorais e morte celular em alguns casos. Na maioria das vezes somente o bloqueio não permite a cura do câncer, mas o objetivo principal é o controle do crescimento tumoral.
Atualmente existem medicamentos novos que auxiliam no bloqueio mais intenso da produção de testosterona ou da inibição potente da ligação do hormônio ao seu receptor, o que tem permitido obter resultados melhores do que o uso isolado dos medicamentos tradicionais do bloqueio hormonal. Alguns exemplos desses medicamentos são abiraterona, enzalutamida, apalutamida e darolutamida.
Alguns pacientes que apresentam doença mais agressiva podem necessitar de quimioterapia intravenosa associada ao bloqueio hormonal para o controle da progressão do tumor. Hoje, um dos tratamentos recomendados para doença metastática é associar o método tradicional de bloqueio hormonal com os medicamentos antiandrogênicos de nova geração ou quimioterapia, dependendo da disponibilidade.
O câncer de próstata metastático tem boa resposta inicial ao bloqueio hormonal – fase conhecida como “câncer de próstata hormônio sensível”–, mas com o tempo pode adquirir a capacidade de se multiplicar e crescer, mesmo com nível baixo de testosterona no organismo – fase conhecida como “câncer de próstata castração resistente”. Nessa segunda fase, geralmente o tratamento é realizado com combinações de medicamentos envolvendo bloqueio hormonal tradicional, medicamentos modernos que bloqueiam a ação do hormônio e quimioterapia, além dos medicamentos modernos em fase de pesquisa clínica. Vale lembrar que o tratamento de câncer metastático é complexo e envolve equipe multidisciplinar (uro-oncologista, oncologista clínico, radioterapeuta, radiologista) para definir a melhor estratégia individualizada para cada paciente.
O tumor não voltou em 5 anos, estou curado?
O câncer de próstata tem crescimento lento na maioria dos casos e as recidivas podem ocorrer muitos anos depois do tratamento inicial com a cirurgia ou radioterapia. Existem tumores que voltam depois de mais de 10 anos. Por isso, muitos estudos científicos que descrevem a taxa de recorrência ou sobrevida acompanham os pacientes por até 10 ou 15 anos após o tratamento inicial. Portanto, no caso de câncer de próstata, não podemos considerar que você está curado ao ficar livre do tumor por 5 anos. Mas, sem dúvida, é uma excelente notícia permanecer 5 anos sem sinais de recidiva tumoral, pois aqueles tumores que demoram muito tempo para recorrer são mais indolentes e responsivos aos tratamentos adicionais no futuro, oferecendo menor risco de se tornar uma doença grave e de difícil controle.
A taxa de sobrevida em 5 anos é basicamente bem próxima de 100% para os pacientes com tumores localizados na próstata, assim como para aqueles tumores localmente avançados, mas sem metástase. O tratamento para tumores mais avançados, metastáticos, tem passado por uma atualização constante com o advento de medicamentos novos e estratégias combinadas de tratamento, permitindo oferecer uma sobrevida cada vez melhor para os pacientes, podendo chegar a mais de 80% de sobrevida em 3 anos e 50% em 5 anos nos estudos mais recentes.
O mais importante é você cuidar da sua saúde como um todo e fazer o seguimento periódico com o seu uro-oncologista. Mesmo quando o tratamento inicial não permite a cura do câncer, hoje existem vários tipos de tratamentos para postergar a progressão do tumor, permitindo ter qualidade de vida e sobrevida prolongada para muitos pacientes.
Sobre o dr. eder
Urologista para tratamento de Câncer de Próstata em São Paulo
Minha jornada na medicina sempre teve um propósito claro: oferecer um tratamento preciso, humano e personalizado para cada paciente. Desde cedo, compreendi que o câncer de próstata exige mais do que apenas conhecimento técnico — demanda planejamento cuidadoso, atualização constante e, acima de tudo, uma abordagem individualizada.
Sou formado pela Faculdade de Medicina da USP, onde também realizei minha residência em Cirurgia Geral e Urologia, além de defender meu doutorado com uma pesquisa voltada para o tratamento cirúrgico do câncer de próstata de alto risco. Minha busca por aperfeiçoamento me levou a especializações em Uro-oncologia e Cirurgia Robótica no Memorial Sloan Kettering Cancer Center, nos Estados Unidos.
Meu foco é oferecer um atendimento de excelência, unindo tecnologia avançada e técnicas minimamente invasivas para garantir os melhores resultados. Acredito que a combinação entre conhecimento atualizado, planejamento detalhado e uma abordagem cirúrgica moderna faz toda a diferença no cuidado do paciente.
Fico à disposição para ajudá-lo no que for necessário. Se precisar,
agende uma consulta para conversarmos sobre as melhores estratégias para o seu caso.

